메디톡신 의혹들, 식약처 왜 몰랐나?…점검은 ‘겉핥기식’
입력 2019.07.11 (21:12)
수정 2019.07.11 (21:21)
읽어주기 기능은 크롬기반의
브라우저에서만 사용하실 수 있습니다.
[앵커]
메디톡신과 관련해 어제(10일)부터 집중 보도한 문제점들은 대략 10년 조금 넘은, 생산 초기에 문제였죠,
전직 직원이 공익제보를 해서 공론화된건데요.
그럼 지금은 괜찮은 것인가, 좀 더 짚어보겠습니다.
이 문제 취재한 엄진아 기자 나와있습니다.
[기자]
네, 결론적으로 현재로서는 알 수 없습니다.
메디톡스사는 현재는 품질에 문제 없는 완벽한 제품만을 생산한다고 강조했는데요.
그런데 저희가 만난 제보자들은, 시스템이 바뀌지 않았으니 여전히 많은 문제가 있을 거라고 말했습니다.
공익제보가 접수된 뒤 식약처가 현장 조사를 실시했고요, 저희 보도 이후 추가 조사를 예고했는데, 여기서 과거의 의혹뿐 아니라 현재의 상황에 대해서도 철저히 밝힐 필요가 있습니다.
[앵커]
그런데, 이렇게 많은 의혹과 불법의 정황이 있었는데, 왜 지금까지 전혀 문제가 불거지지 않았을까요?
[기자]
그건 권한을 가진 식약처의 점검이 부실했다고밖에 볼 수 없습니다.
앞서 보도했듯이 허가 과정에서도 식약처가 제대로 권한을 행사했을지 의문인데요.
그 이후의 점검도 형식에 그쳤습니다.
사실 메디특신과 관련해서는 꽤 오래 전부터 말들이 많았었는데요,
식약처가 그동안 사실이다 아니다 확인하거나 적발한 위법 행위는 하나도 없었습니다.
[앵커]
점검을 어떻게 하길래 형식에 그쳤다는 겁니까?
[기자]
식약처는 새로운 약품 허가를 내준 뒤에 3년에 한 번씩 정기 점검을 합니다.
민원 등이 제기되면 수시 점검도 하는데요.
생산 시설을 둘러보고 제약사가 제출한 기록과 서류를 검토하는 수준이었습니다.
점검 일정도 사전에 제약사에 알려줍니다.
[앵커]
제약사 입장에선 미리 준비할 시간이 있는 거군요?
만약에 제약사가 서류를 거짓으로 꾸며도 적발하기 어려운 구조인 것 같은데요?
[기자]
네, 적발을 안 하는 게 아니라 못 하는 것일 수도 있습니다.
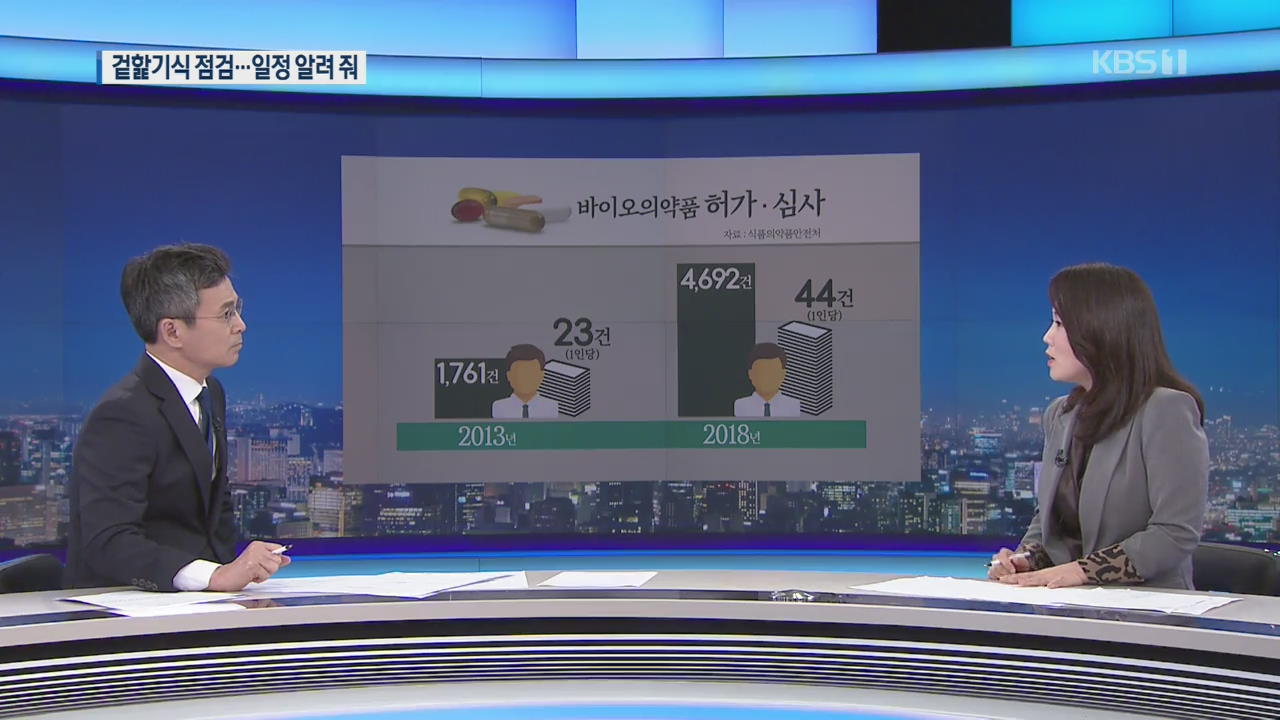
바이오시장이 커지면서 최근 5년 사이 품목 허가를 신청이 3배 가까이 늘었습니다.
직원 한 명당 업무량이 폭증했습니다.
서류 심사 위주로 진행되는 것도 한계가 있는데 상황이 더 열악해진 거죠.
[앵커]
최근 인보사 사태도 있었고, 정부가 미래 먹거리로 꼽은 바이오산업.
이런 식이라면 제대로 육성할 수 있겠습니까?
[기자]
네, 사실 인보사도 2006년 품목 허가를 받은 이후 국내에서 별 탈 없이 팔려나갔습니다.
그러다 미국 FDA, 우리나라로 보면 식약처와 같은 기관의 임상 단계에서 문제가 확인된 거거든요.
지금과 같은 부실한 관리체계로는 까다로운 세계 시장의 벽을 넘지 못할 것이라는 지적이 많습니다.
이런 상황은 식약처가 바이오의약품을 육성하는 '산업'의 기능과 이 약품이 제대로 유통되고 있는지를 확인하는 '감독'의 기능 모두를 갖고 있기 때문이기도 합니다.
[앵커]
식약처 안에서도 이해충돌이 존재하니까 온정주의가 생길 수 있다, 이런 지적이군요?
개선이 필요하겠습니다.
엄진아 기자였습니다.
메디톡신과 관련해 어제(10일)부터 집중 보도한 문제점들은 대략 10년 조금 넘은, 생산 초기에 문제였죠,
전직 직원이 공익제보를 해서 공론화된건데요.
그럼 지금은 괜찮은 것인가, 좀 더 짚어보겠습니다.
이 문제 취재한 엄진아 기자 나와있습니다.
[기자]
네, 결론적으로 현재로서는 알 수 없습니다.
메디톡스사는 현재는 품질에 문제 없는 완벽한 제품만을 생산한다고 강조했는데요.
그런데 저희가 만난 제보자들은, 시스템이 바뀌지 않았으니 여전히 많은 문제가 있을 거라고 말했습니다.
공익제보가 접수된 뒤 식약처가 현장 조사를 실시했고요, 저희 보도 이후 추가 조사를 예고했는데, 여기서 과거의 의혹뿐 아니라 현재의 상황에 대해서도 철저히 밝힐 필요가 있습니다.
[앵커]
그런데, 이렇게 많은 의혹과 불법의 정황이 있었는데, 왜 지금까지 전혀 문제가 불거지지 않았을까요?
[기자]
그건 권한을 가진 식약처의 점검이 부실했다고밖에 볼 수 없습니다.
앞서 보도했듯이 허가 과정에서도 식약처가 제대로 권한을 행사했을지 의문인데요.
그 이후의 점검도 형식에 그쳤습니다.
사실 메디특신과 관련해서는 꽤 오래 전부터 말들이 많았었는데요,
식약처가 그동안 사실이다 아니다 확인하거나 적발한 위법 행위는 하나도 없었습니다.
[앵커]
점검을 어떻게 하길래 형식에 그쳤다는 겁니까?
[기자]
식약처는 새로운 약품 허가를 내준 뒤에 3년에 한 번씩 정기 점검을 합니다.
민원 등이 제기되면 수시 점검도 하는데요.
생산 시설을 둘러보고 제약사가 제출한 기록과 서류를 검토하는 수준이었습니다.
점검 일정도 사전에 제약사에 알려줍니다.
[앵커]
제약사 입장에선 미리 준비할 시간이 있는 거군요?
만약에 제약사가 서류를 거짓으로 꾸며도 적발하기 어려운 구조인 것 같은데요?
[기자]
네, 적발을 안 하는 게 아니라 못 하는 것일 수도 있습니다.
바이오시장이 커지면서 최근 5년 사이 품목 허가를 신청이 3배 가까이 늘었습니다.
직원 한 명당 업무량이 폭증했습니다.
서류 심사 위주로 진행되는 것도 한계가 있는데 상황이 더 열악해진 거죠.
[앵커]
최근 인보사 사태도 있었고, 정부가 미래 먹거리로 꼽은 바이오산업.
이런 식이라면 제대로 육성할 수 있겠습니까?
[기자]
네, 사실 인보사도 2006년 품목 허가를 받은 이후 국내에서 별 탈 없이 팔려나갔습니다.
그러다 미국 FDA, 우리나라로 보면 식약처와 같은 기관의 임상 단계에서 문제가 확인된 거거든요.
지금과 같은 부실한 관리체계로는 까다로운 세계 시장의 벽을 넘지 못할 것이라는 지적이 많습니다.
이런 상황은 식약처가 바이오의약품을 육성하는 '산업'의 기능과 이 약품이 제대로 유통되고 있는지를 확인하는 '감독'의 기능 모두를 갖고 있기 때문이기도 합니다.
[앵커]
식약처 안에서도 이해충돌이 존재하니까 온정주의가 생길 수 있다, 이런 지적이군요?
개선이 필요하겠습니다.
엄진아 기자였습니다.
■ 제보하기
▷ 카카오톡 : 'KBS제보' 검색, 채널 추가
▷ 전화 : 02-781-1234, 4444
▷ 이메일 : kbs1234@kbs.co.kr
▷ 유튜브, 네이버, 카카오에서도 KBS뉴스를 구독해주세요!
- 메디톡신 의혹들, 식약처 왜 몰랐나?…점검은 ‘겉핥기식’
-
- 입력 2019-07-11 21:13:17
- 수정2019-07-11 21:21:41
[앵커]
메디톡신과 관련해 어제(10일)부터 집중 보도한 문제점들은 대략 10년 조금 넘은, 생산 초기에 문제였죠,
전직 직원이 공익제보를 해서 공론화된건데요.
그럼 지금은 괜찮은 것인가, 좀 더 짚어보겠습니다.
이 문제 취재한 엄진아 기자 나와있습니다.
[기자]
네, 결론적으로 현재로서는 알 수 없습니다.
메디톡스사는 현재는 품질에 문제 없는 완벽한 제품만을 생산한다고 강조했는데요.
그런데 저희가 만난 제보자들은, 시스템이 바뀌지 않았으니 여전히 많은 문제가 있을 거라고 말했습니다.
공익제보가 접수된 뒤 식약처가 현장 조사를 실시했고요, 저희 보도 이후 추가 조사를 예고했는데, 여기서 과거의 의혹뿐 아니라 현재의 상황에 대해서도 철저히 밝힐 필요가 있습니다.
[앵커]
그런데, 이렇게 많은 의혹과 불법의 정황이 있었는데, 왜 지금까지 전혀 문제가 불거지지 않았을까요?
[기자]
그건 권한을 가진 식약처의 점검이 부실했다고밖에 볼 수 없습니다.
앞서 보도했듯이 허가 과정에서도 식약처가 제대로 권한을 행사했을지 의문인데요.
그 이후의 점검도 형식에 그쳤습니다.
사실 메디특신과 관련해서는 꽤 오래 전부터 말들이 많았었는데요,
식약처가 그동안 사실이다 아니다 확인하거나 적발한 위법 행위는 하나도 없었습니다.
[앵커]
점검을 어떻게 하길래 형식에 그쳤다는 겁니까?
[기자]
식약처는 새로운 약품 허가를 내준 뒤에 3년에 한 번씩 정기 점검을 합니다.
민원 등이 제기되면 수시 점검도 하는데요.
생산 시설을 둘러보고 제약사가 제출한 기록과 서류를 검토하는 수준이었습니다.
점검 일정도 사전에 제약사에 알려줍니다.
[앵커]
제약사 입장에선 미리 준비할 시간이 있는 거군요?
만약에 제약사가 서류를 거짓으로 꾸며도 적발하기 어려운 구조인 것 같은데요?
[기자]
네, 적발을 안 하는 게 아니라 못 하는 것일 수도 있습니다.
바이오시장이 커지면서 최근 5년 사이 품목 허가를 신청이 3배 가까이 늘었습니다.
직원 한 명당 업무량이 폭증했습니다.
서류 심사 위주로 진행되는 것도 한계가 있는데 상황이 더 열악해진 거죠.
[앵커]
최근 인보사 사태도 있었고, 정부가 미래 먹거리로 꼽은 바이오산업.
이런 식이라면 제대로 육성할 수 있겠습니까?
[기자]
네, 사실 인보사도 2006년 품목 허가를 받은 이후 국내에서 별 탈 없이 팔려나갔습니다.
그러다 미국 FDA, 우리나라로 보면 식약처와 같은 기관의 임상 단계에서 문제가 확인된 거거든요.
지금과 같은 부실한 관리체계로는 까다로운 세계 시장의 벽을 넘지 못할 것이라는 지적이 많습니다.
이런 상황은 식약처가 바이오의약품을 육성하는 '산업'의 기능과 이 약품이 제대로 유통되고 있는지를 확인하는 '감독'의 기능 모두를 갖고 있기 때문이기도 합니다.
[앵커]
식약처 안에서도 이해충돌이 존재하니까 온정주의가 생길 수 있다, 이런 지적이군요?
개선이 필요하겠습니다.
엄진아 기자였습니다.
메디톡신과 관련해 어제(10일)부터 집중 보도한 문제점들은 대략 10년 조금 넘은, 생산 초기에 문제였죠,
전직 직원이 공익제보를 해서 공론화된건데요.
그럼 지금은 괜찮은 것인가, 좀 더 짚어보겠습니다.
이 문제 취재한 엄진아 기자 나와있습니다.
[기자]
네, 결론적으로 현재로서는 알 수 없습니다.
메디톡스사는 현재는 품질에 문제 없는 완벽한 제품만을 생산한다고 강조했는데요.
그런데 저희가 만난 제보자들은, 시스템이 바뀌지 않았으니 여전히 많은 문제가 있을 거라고 말했습니다.
공익제보가 접수된 뒤 식약처가 현장 조사를 실시했고요, 저희 보도 이후 추가 조사를 예고했는데, 여기서 과거의 의혹뿐 아니라 현재의 상황에 대해서도 철저히 밝힐 필요가 있습니다.
[앵커]
그런데, 이렇게 많은 의혹과 불법의 정황이 있었는데, 왜 지금까지 전혀 문제가 불거지지 않았을까요?
[기자]
그건 권한을 가진 식약처의 점검이 부실했다고밖에 볼 수 없습니다.
앞서 보도했듯이 허가 과정에서도 식약처가 제대로 권한을 행사했을지 의문인데요.
그 이후의 점검도 형식에 그쳤습니다.
사실 메디특신과 관련해서는 꽤 오래 전부터 말들이 많았었는데요,
식약처가 그동안 사실이다 아니다 확인하거나 적발한 위법 행위는 하나도 없었습니다.
[앵커]
점검을 어떻게 하길래 형식에 그쳤다는 겁니까?
[기자]
식약처는 새로운 약품 허가를 내준 뒤에 3년에 한 번씩 정기 점검을 합니다.
민원 등이 제기되면 수시 점검도 하는데요.
생산 시설을 둘러보고 제약사가 제출한 기록과 서류를 검토하는 수준이었습니다.
점검 일정도 사전에 제약사에 알려줍니다.
[앵커]
제약사 입장에선 미리 준비할 시간이 있는 거군요?
만약에 제약사가 서류를 거짓으로 꾸며도 적발하기 어려운 구조인 것 같은데요?
[기자]
네, 적발을 안 하는 게 아니라 못 하는 것일 수도 있습니다.
바이오시장이 커지면서 최근 5년 사이 품목 허가를 신청이 3배 가까이 늘었습니다.
직원 한 명당 업무량이 폭증했습니다.
서류 심사 위주로 진행되는 것도 한계가 있는데 상황이 더 열악해진 거죠.
[앵커]
최근 인보사 사태도 있었고, 정부가 미래 먹거리로 꼽은 바이오산업.
이런 식이라면 제대로 육성할 수 있겠습니까?
[기자]
네, 사실 인보사도 2006년 품목 허가를 받은 이후 국내에서 별 탈 없이 팔려나갔습니다.
그러다 미국 FDA, 우리나라로 보면 식약처와 같은 기관의 임상 단계에서 문제가 확인된 거거든요.
지금과 같은 부실한 관리체계로는 까다로운 세계 시장의 벽을 넘지 못할 것이라는 지적이 많습니다.
이런 상황은 식약처가 바이오의약품을 육성하는 '산업'의 기능과 이 약품이 제대로 유통되고 있는지를 확인하는 '감독'의 기능 모두를 갖고 있기 때문이기도 합니다.
[앵커]
식약처 안에서도 이해충돌이 존재하니까 온정주의가 생길 수 있다, 이런 지적이군요?
개선이 필요하겠습니다.
엄진아 기자였습니다.
-
-

엄진아 기자 aza@kbs.co.kr
엄진아 기자의 기사 모음
-
이 기사가 좋으셨다면
-
좋아요
0
-
응원해요
0
-
후속 원해요
0















![[단독] “쿵쿵거리지 마” 이웃에 가스총 발사 난동 60대 체포](/data/layer/904/2024/04/20240426_kEfhp6.jpg)

이 기사에 대한 의견을 남겨주세요.