신약 부작용도 1년 2개월 늑장보고…‘판매 허가’ 유지
입력 2016.10.04 (21:19)
수정 2016.10.04 (22:14)
읽어주기 기능은 크롬기반의
브라우저에서만 사용하실 수 있습니다.
<앵커 멘트>
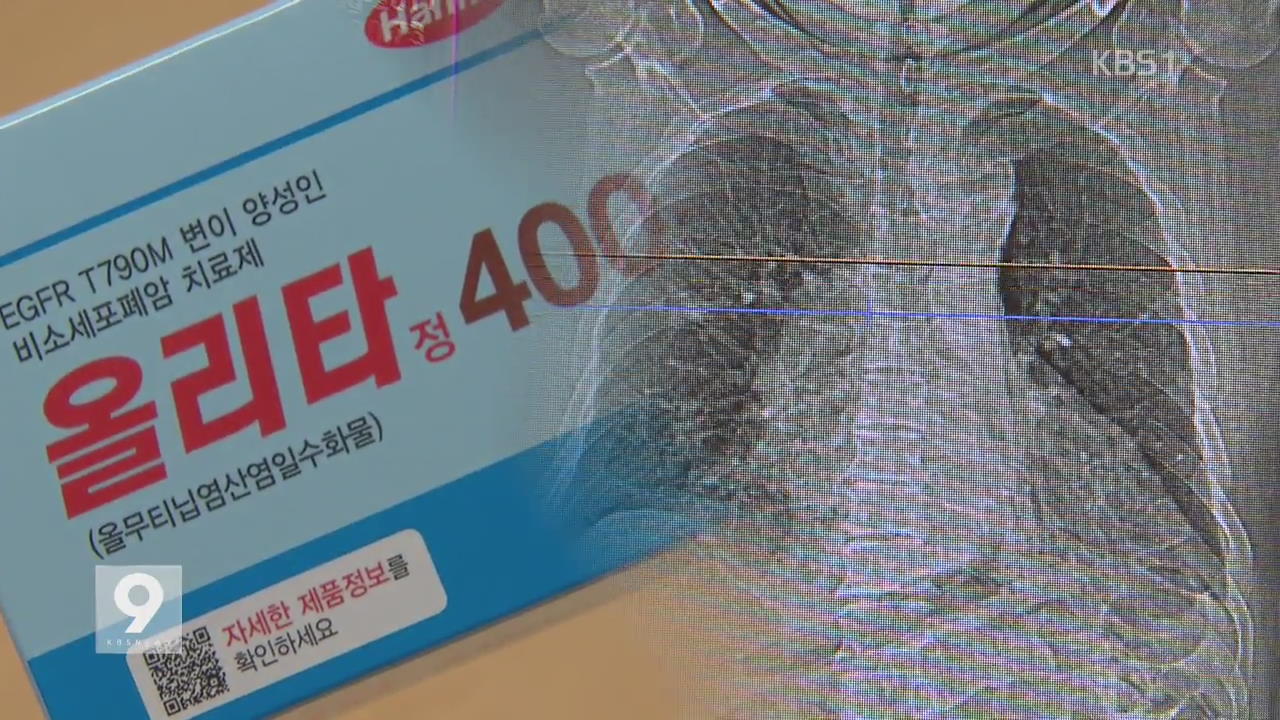
한미약품이 폐암 신약 '올리타'의 부작용을 1년 2개월이나 늦게 보고한 것으로 드러나 정부가 경위 조사에 들어갔습니다.
논란에도 불구하고 식약처는 '올리타'의 조건부 판매 허가를 일단 유지하기로 했습니다.
임종빈 기자입니다.
<리포트>
한미약품은 올 들어 식약처에 모두 3차례에 걸쳐 신약 '올리타'의 부작용을 보고했습니다.
지난 4월과 6월, 그리고 지난달, 모두 신약 투약 환자에게서 중증 피부질환이 발생했다는 내용입니다.
이 가운데 지난달에 보고한 부작용은 1년 2개월 전인 지난해 7월에 발생했던 것으로 드러났습니다.
늑장 보고 논란에 대해 한미약품 측은 당시엔 신약 부작용이라고 판단하기 어려웠다고 해명했지만, 식약처는 임상을 진행한 의사 등을 상대로 조사에 착수한 상탭니다.
<녹취> 이원식(식약처 의약품안전과장) : "제약사와 임상 시험자 모두에게 (보고) 의무가 있습니다."
한미약품 측은 식약처의 추가 자료 요청에 대해서도 지난달 29일에야 자료 제출을 마무리했습니다.
문제의 29일은 한미약품이 1조 원대의 기술수출 계약을 체결했다고 공시한 날입니다.
이어 다음 날 아침에는 베링거인겔하임의 수출 계약 해지가 공시됐고, 식약처는 뒤늦게 신약의 부작용을 공개했습니다.
각종 논란에도 불구하고 식약처는 다른 대안이 없는 말기 암 환자들의 치료 등을 위해 올리타의 조건부 판매 허가를 일단 유지하기로 결정했습니다.
KBS 뉴스 임종빈입니다.
한미약품이 폐암 신약 '올리타'의 부작용을 1년 2개월이나 늦게 보고한 것으로 드러나 정부가 경위 조사에 들어갔습니다.
논란에도 불구하고 식약처는 '올리타'의 조건부 판매 허가를 일단 유지하기로 했습니다.
임종빈 기자입니다.
<리포트>
한미약품은 올 들어 식약처에 모두 3차례에 걸쳐 신약 '올리타'의 부작용을 보고했습니다.
지난 4월과 6월, 그리고 지난달, 모두 신약 투약 환자에게서 중증 피부질환이 발생했다는 내용입니다.
이 가운데 지난달에 보고한 부작용은 1년 2개월 전인 지난해 7월에 발생했던 것으로 드러났습니다.
늑장 보고 논란에 대해 한미약품 측은 당시엔 신약 부작용이라고 판단하기 어려웠다고 해명했지만, 식약처는 임상을 진행한 의사 등을 상대로 조사에 착수한 상탭니다.
<녹취> 이원식(식약처 의약품안전과장) : "제약사와 임상 시험자 모두에게 (보고) 의무가 있습니다."
한미약품 측은 식약처의 추가 자료 요청에 대해서도 지난달 29일에야 자료 제출을 마무리했습니다.
문제의 29일은 한미약품이 1조 원대의 기술수출 계약을 체결했다고 공시한 날입니다.
이어 다음 날 아침에는 베링거인겔하임의 수출 계약 해지가 공시됐고, 식약처는 뒤늦게 신약의 부작용을 공개했습니다.
각종 논란에도 불구하고 식약처는 다른 대안이 없는 말기 암 환자들의 치료 등을 위해 올리타의 조건부 판매 허가를 일단 유지하기로 결정했습니다.
KBS 뉴스 임종빈입니다.
■ 제보하기
▷ 카카오톡 : 'KBS제보' 검색, 채널 추가
▷ 전화 : 02-781-1234, 4444
▷ 이메일 : kbs1234@kbs.co.kr
▷ 유튜브, 네이버, 카카오에서도 KBS뉴스를 구독해주세요!
- 신약 부작용도 1년 2개월 늑장보고…‘판매 허가’ 유지
-
- 입력 2016-10-04 21:21:24
- 수정2016-10-04 22:14:13
<앵커 멘트>
한미약품이 폐암 신약 '올리타'의 부작용을 1년 2개월이나 늦게 보고한 것으로 드러나 정부가 경위 조사에 들어갔습니다.
논란에도 불구하고 식약처는 '올리타'의 조건부 판매 허가를 일단 유지하기로 했습니다.
임종빈 기자입니다.
<리포트>
한미약품은 올 들어 식약처에 모두 3차례에 걸쳐 신약 '올리타'의 부작용을 보고했습니다.
지난 4월과 6월, 그리고 지난달, 모두 신약 투약 환자에게서 중증 피부질환이 발생했다는 내용입니다.
이 가운데 지난달에 보고한 부작용은 1년 2개월 전인 지난해 7월에 발생했던 것으로 드러났습니다.
늑장 보고 논란에 대해 한미약품 측은 당시엔 신약 부작용이라고 판단하기 어려웠다고 해명했지만, 식약처는 임상을 진행한 의사 등을 상대로 조사에 착수한 상탭니다.
<녹취> 이원식(식약처 의약품안전과장) : "제약사와 임상 시험자 모두에게 (보고) 의무가 있습니다."
한미약품 측은 식약처의 추가 자료 요청에 대해서도 지난달 29일에야 자료 제출을 마무리했습니다.
문제의 29일은 한미약품이 1조 원대의 기술수출 계약을 체결했다고 공시한 날입니다.
이어 다음 날 아침에는 베링거인겔하임의 수출 계약 해지가 공시됐고, 식약처는 뒤늦게 신약의 부작용을 공개했습니다.
각종 논란에도 불구하고 식약처는 다른 대안이 없는 말기 암 환자들의 치료 등을 위해 올리타의 조건부 판매 허가를 일단 유지하기로 결정했습니다.
KBS 뉴스 임종빈입니다.
한미약품이 폐암 신약 '올리타'의 부작용을 1년 2개월이나 늦게 보고한 것으로 드러나 정부가 경위 조사에 들어갔습니다.
논란에도 불구하고 식약처는 '올리타'의 조건부 판매 허가를 일단 유지하기로 했습니다.
임종빈 기자입니다.
<리포트>
한미약품은 올 들어 식약처에 모두 3차례에 걸쳐 신약 '올리타'의 부작용을 보고했습니다.
지난 4월과 6월, 그리고 지난달, 모두 신약 투약 환자에게서 중증 피부질환이 발생했다는 내용입니다.
이 가운데 지난달에 보고한 부작용은 1년 2개월 전인 지난해 7월에 발생했던 것으로 드러났습니다.
늑장 보고 논란에 대해 한미약품 측은 당시엔 신약 부작용이라고 판단하기 어려웠다고 해명했지만, 식약처는 임상을 진행한 의사 등을 상대로 조사에 착수한 상탭니다.
<녹취> 이원식(식약처 의약품안전과장) : "제약사와 임상 시험자 모두에게 (보고) 의무가 있습니다."
한미약품 측은 식약처의 추가 자료 요청에 대해서도 지난달 29일에야 자료 제출을 마무리했습니다.
문제의 29일은 한미약품이 1조 원대의 기술수출 계약을 체결했다고 공시한 날입니다.
이어 다음 날 아침에는 베링거인겔하임의 수출 계약 해지가 공시됐고, 식약처는 뒤늦게 신약의 부작용을 공개했습니다.
각종 논란에도 불구하고 식약처는 다른 대안이 없는 말기 암 환자들의 치료 등을 위해 올리타의 조건부 판매 허가를 일단 유지하기로 결정했습니다.
KBS 뉴스 임종빈입니다.
-
-

임종빈 기자 chef@kbs.co.kr
임종빈 기자의 기사 모음
-
이 기사가 좋으셨다면
-
좋아요
0
-
응원해요
0
-
후속 원해요
0











![[속보] 청주시, 오송읍 정중리 마을 주민 정중1리 마을 회관으로 대피령](/attach/image/2025/03/23/20250323_8Sjy5d.jpg)
![[속보] 전국 16곳 홍수특보…금강 유역 하천 15곳 ‘심각’ 단계](/data/layer/904/2025/07/20250717_pwQQXE.jpg)

![[속보] 내란특검, ‘단전·단수 의혹’ 이상민 전 장관·소방청 압수수색](/data/layer/904/2025/07/20250717_F0Ur39.jpg)

이 기사에 대한 의견을 남겨주세요.